- La toxoplasmosis es una zoonosis de transmisión alimentaria cuyo agente etiológico es el parásito apicomplejo formador de quistes Toxoplasma gondii.
- De distribución cosmopolita, puede derivar en graves repercusiones en la salud humana y animal. Se estima que un tercio de la población mundial está infectada.
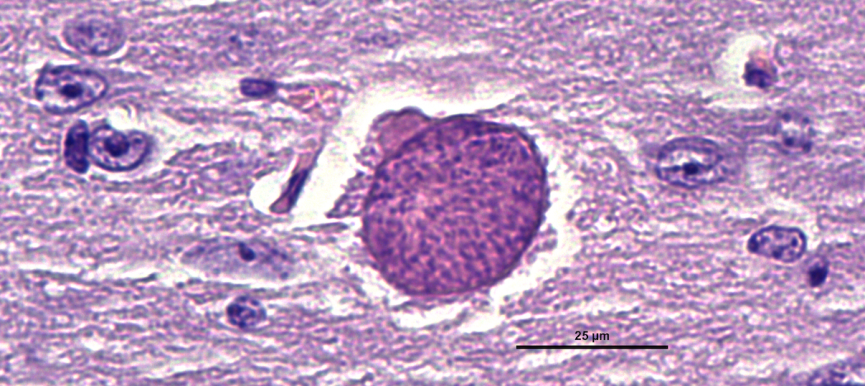
- Se han descrito tres estadios parasitarios que son infectantes para el ser humano: el taquizoíto, responsable de la fase aguda de la enfermedad, el bradizoíto en el interior de quistes tisulares de replicación lenta y responsable de la fase crónica, y el esporozoíto en el interior de los ooquistes que se eliminan en las heces de los felinos (hospedador definitivo) y que son la fase de resistencia en el ambiente.
- Toxoplasma gondii puede infectar cualquier especie homeoterma. Las personas pueden adquirir la infección: a) de forma congénita (infección in utero; el estadio infectante es el taquizoíto); b) por el consumo de carne cruda que contenga quistes tisulares o sometida a un tratamiento térmico insuficiente (ruta cárnica; el estadio infectante es el bradizoíto); c) mediante la ingestión de ooquistes (el estadio infectante es el esporozoíto) tras el contacto con las heces del gato, con superficies contaminadas (p. ej. tareas de jardinería) (transmisión fecal-oral) o por el consumo de agua, frutas y verduras crudas contaminadas con ooquistes (ruta ambiental). Otros modos menos frecuentes de adquirir la infección son por transfusión sanguínea con sangre que contiene taquizoítos, el trasplante de órganos con quistes tisulares con bradizoítos y el consumo de leche de cabra contaminada con taquizoítos (Figura 1).
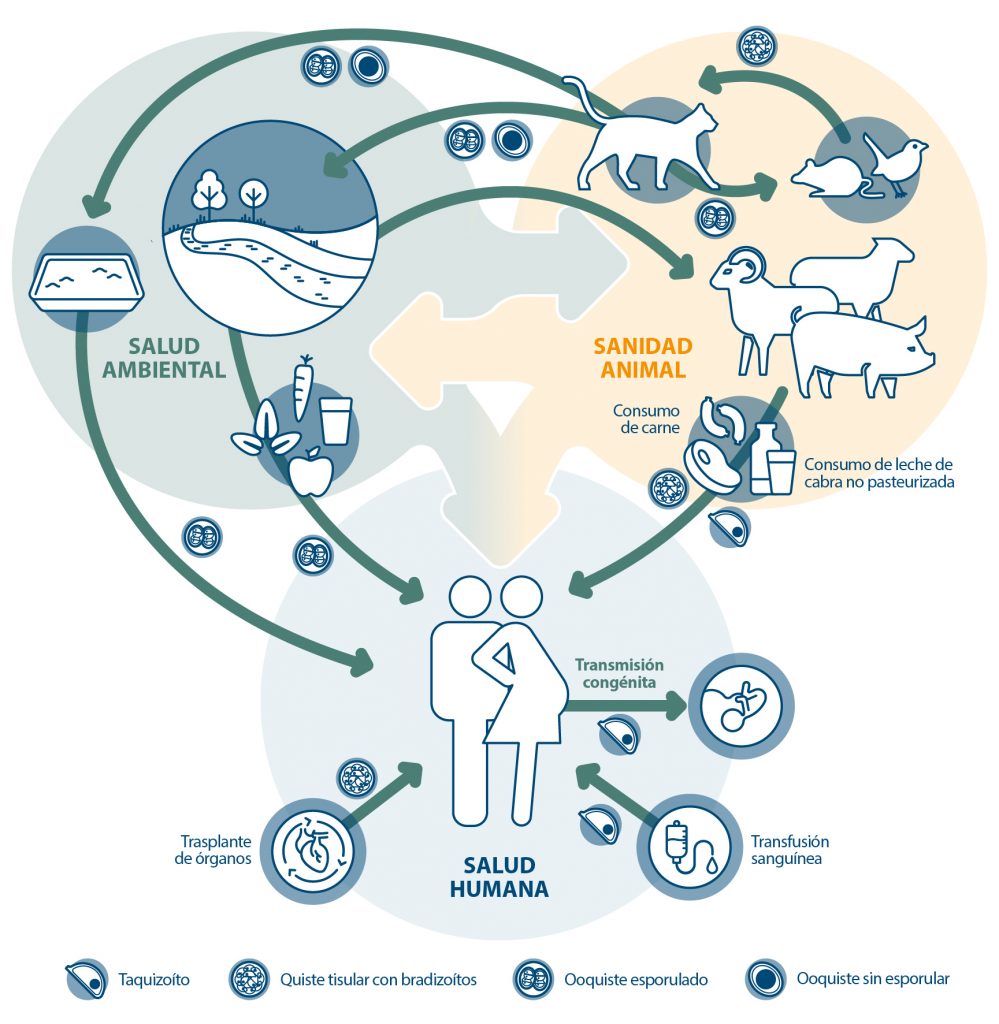
Figura 1: Vías de transmisión de Toxoplasma gondii en el ser humano.
La toxoplasmosis, una de las principales zoonosis alimentarias
- En Europa, la Autoridad Sanitaria Europea en Seguridad Alimentaria (EFSA) ha identificado a T. gondii como uno de los tres parásitos de transmisión alimentaria más importantes que no están sometidos a control en los alimentos. En EE.UU, la toxoplasmosis es considerada la tercera zoonosis de transmisión alimentaria más importante en los humanos y la segunda causa de mortalidad asociada a las zoonosis de transmisión alimentaria según el Centro de Control de Enfermedades (CDC).
- La amplia gama de especies animales que actúan como hospedadores del parásito, el complejo ciclo biológico y los numerosos modos de transmisión, junto con la ausencia de monitorización de la presencia de T. gondii en los alimentos, dificultan la estimación de la importancia relativa de cada una de las fuentes de infección y el diseño de estrategias de control en función de la situación epidemiológica dentro del marco “Una Sola Salud” (One Health).
- Los datos publicados sobre los brotes mundiales de toxoplasmosis mostraron que el 47,1% estaban asociados a la ruta cárnica frente al 44,1% que lo estaban a la ruta ambiental. Los brotes vinculados al consumo de alimentos se atribuyen “principalmente” a la carne de animales infectados y, en menor medida, a los productos frescos (frutas y verduras) y productos lácteos sin pasteurizar.
- Diferentes estudios han identificado al consumo de carne de cerdo, pequeños rumiantes, cérvidos e incluso de ganado vacuno, como las principales fuentes de infección asociadas a la ruta cárnica. Respecto a los productos vegetales frescos, se han detectado ooquistes de T. gondii en diferentes tipos de verduras (p. ej. las lechugas), hortalizas (p. ej. las zanahorias), hierbas aromáticas y frutas (p. ej. fresas).
- También se consideran factores de riesgo de la infección la existencia de poblaciones de gatos callejeros en áreas urbanas, el consumo de agua ya que los ooquistes son resistentes a los tratamientos de potabilización y el consumo de moluscos bivalvos no sometidos a ningún tratamiento térmico, si bien los estudios sobre la presencia de T. gondii en los moluscos bivalvos son escasos, con resultados muy variables y no se ha demostrado la infectividad de los ooquistes presentes.
- La toxoplasmosis puede tener consecuencias graves para el feto y las personas inmunodeprimidas. Debido al riesgo que supone la primoinfección por T. gondii en las mujeres embarazadas, la legislación española (RD 298/2009; Guía técnica del Instituto Nacional de Seguridad e Higiene en el Trabajo sobre exposición a agentes biológicos) establece que la trabajadora embarazada no podrá realizar actividades que supongan riesgo de exposición a T. gondii, el cual está clasificado dentro de los agentes biológicos del grupo de riesgo 2 (aquellos patógenos que pueden causar una enfermedad y constituir un peligro para los trabajadores, cuyo riesgo de propagación a la colectividad es poco probable y frente a los cuales generalmente existe tratamiento).
- En España la seroprevalencia de la infección por T. gondii en mujeres gestantes oscila entre el 12 y el 32% según estudios publicados en las últimas dos décadas. Se estima que cada año hay más de 190.000 casos de toxoplasmosis congénita (TC) en el mundo. En Europa, la incidencia de la TC es de 1-10 casos por cada 10.000 recién nacidos, de los cuales hasta 1-2% desarrollan retraso mental o mueren y entre 4-27% desarrollarán coriorretinitis. La TC es una enfermedad de declaración obligatoria en España (Orden 445/2015).
¿Cuál es la clínica de la toxoplasmosis y cómo se diagnostica en las personas?
- Toxoplasma gondii normalmente causa una infección subclínica en las personas inmunocompetentes, las cuales pueden presentar síntomas similares a los de una gripe durante unos días o semanas (fiebre, dolor muscular y linfoadenomegalia). Posteriormente, el parásito se acantona en el interior de quistes tisulares en tejidos inmunoprivilegiados (p. ej. el sistema nervioso central, la retina y musculatura esquelética) y las personas permanecen infectadas de forma asintomática de por vida.
- La toxoplasmosis clínica se puede presentar de forma aguda tras: a) la reactivación de una infección crónica en pacientes inmunocomprometidos (p. ej. pacientes con el virus de la inmunodeficiencia humana o sometidos a tratamientos inmunosupresores durante el cáncer o el trasplante de células sanguíneas o asociado a un trasplante de un órgano sólido) y b) de forma congénita, normalmente tras una primoinfección durante la gestación (menos frecuente cuando ésta tiene lugar los tres meses anteriores a la gestación o por reactivación de una infección crónica asociada a una inmunosupresión durante la gestación).
- Los pacientes inmunocomprometidos desarrollan cuadros graves con afectación del sistema nervioso central (encefalitis), la retina (coriorretinitis) y otros órganos (p. ej. corazón, hígado) siendo una infección oportunista grave en estas situaciones o incluso mortal en ausencia de tratamiento.
- El riesgo de infección fetal depende de la edad gestacional, que disminuye según avanza la gestación o de si la madre ha recibido algún tratamiento. La TC puede provocar el aborto, malformaciones congénitas (microcefalia, macrocefalia, alteraciones oculares y auditivas) o el nacimiento de niños congénitamente infectados con sintomatología o aparentemente sanos que podrían presentar secuelas neurológicas y oculares transcurridos unos años. La toxoplasmosis es una de las principales causas de uveítis posterior en infecciones postnatales. El diagnóstico de la TC puede realizarse durante la gestación o en los recién nacidos. Durante la gestación se realiza la detección pareada de los isotipos de inmunoglobulinas IgG e IgM mediante pruebas serológicas. Un resultado IgM+/IgG- o IgM+/IgG+ indica una infección aguda, mientras que IgM-/IgG+ una infección crónica. Las pruebas serológicas de avidez pueden ayudar a diagnosticar una infección aguda, ya que valores bajos de avidez indican una infección adquirida durante los últimos cuatro meses. Tras confirmar una infección aguda en la madre, posteriormente se recomienda realizar la detección del parásito en el líquido amniótico mediante PCR. Los recién nacidos con una TC presentan IgMs a los 10 días del nacimiento y las IgGs persisten transcurrido el primer año de vida. En el caso de pacientes inmunocomprometidos no se recomienda el diagnóstico serológico y se debe recoger muestras de lavado broncoalveolar o biopsias de linfonódulos para detectar el parásito mediante PCR.
- En los últimos años diferentes estudios han señalado la posible asociación entre una infección crónica asintomática con alteraciones neurológicas como la esquizofrenia, demencia, tendencias suicidas o incluso cambios de personalidad, aunque se desconoce la incidencia y el mecanismo patogénico causante.
Opciones terapéuticas en los humanos y medidas de control
- Durante los últimos años y en diferentes países se ha observado un descenso en la seroprevalencia debido a la educación sanitaria y a las mejoras en la higiene alimentaria que incluyen: lavado de manos antes de manipular los alimentos, lavado de verduras, pelado de frutas, limpieza de superficies y del material empleado en el corte de la carne, congelación (<-12ºC) o tratamiento térmico (>66ºC) de los productos cárnicos, evitar consumo de productos lácteos no pasteurizados, empleo de guantes al cambiar la cama del gato y en tareas de jardinería y empleo de dieta comercial para alimentar a los gatos.
- Los tratamientos están indicados para combatir el estadio de taquizoíto pero no eliminan los quistes tisulares. Por tanto, el tratamiento frente a la toxoplasmosis solo debe administrarse en casos de toxoplasmosis clínica. En la TC las opciones terapéuticas deben evaluarse de forma individual para cada caso. De forma general, ante una sospecha de TC basada en un diagnóstico serológico de la madre gestante, debe considerarse la administración preventiva de espiromicina para prevenir la transmisión transplacentaria. Una vez confirmada la infección en el feto se recomienda el empleo de pirimetamina, sulfadiacina y ácido fólico. Ante un diagnóstico de toxoplasmosis aguda en una mujer no gestante se recomienda que espere al menos seis meses hasta intentar quedarse gestante. En el caso de los recién nacidos y los pacientes inmunodeprimidos se recomienda la administración de pirimetamina, sulfadiacina y ácido fólico. Otras alternativas terapéuticas son la clindamicina o la combinación de trimetroprim-sulfametoxazol. La duración media de los tratamientos oscila entre 4-6 semanas, pero puede extenderse hasta más de 6 meses.
- Hay que tener en cuenta que la eficacia de estos tratamientos frente a una toxoplasmosis clínica no supera el 90% en el mejor de los casos y, que una vez finalizado el tratamiento, hay riesgo de recidivas asociadas a una reactivación de una infección latente, las cuales son muy frecuentes en los casos de toxoplasmosis ocular. Además, no hay que olvidar los posibles efectos secundarios como deficiencia del ácido fólico, supresión de la médula ósea o incluso alergia. Por tanto, es necesario contar con nuevas herramientas terapéuticas que solventen estas limitaciones, reduzcan el periodo de tratamiento y que sean eficaces frente al estadio de bradizoíto.
- La monitorización de la infección durante la gestación y el tratamiento reducen la probabilidad de transmisión de T. gondii al feto y la gravedad de las secuelas de la infección. También se recomienda la monitorización serológica de las personas donantes y receptores de órganos para evitar una reactivación de una infección latente tras el empleo de un tratamiento inmunosupresor antes y después del trasplante.
- La vacunación frente a T. gondii del ganado ovino y evitar la presencia de gatos en las explotaciones ganaderas contribuye a reducir la presencia de T. gondii en los productos cárnicos y en el ambiente. Así mismo, en un futuro sería deseable contar con una vacuna que pudiera emplearse en el ganado porcino e incluso con posibilidad de uso en las personas.