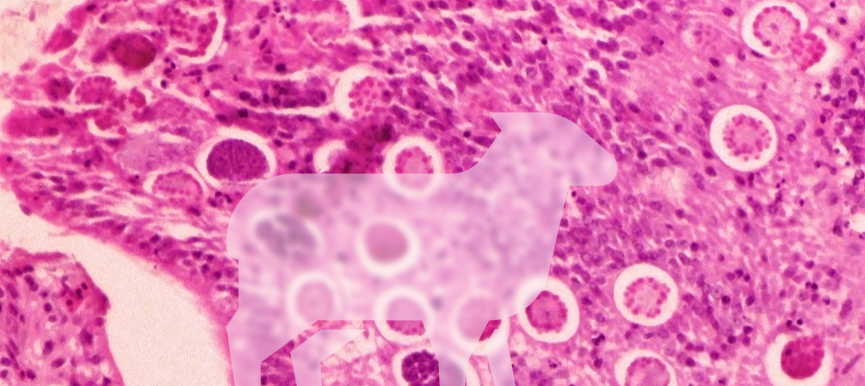
Figura 1. Fases de desarrollo intestinal (gamogonia) de Eimeria. H&E x20.
La eimeriosis o coccidiosis de la oveja y de la cabra está causada por protistas intracelulares pertenecientes al género Eimeria (Apicomplexa, Alveolata) que incluye numerosas especies de localización intestinal cuyo ciclo biológico es monoxeno. Son específicas de hospedador, no existiendo transmisión cruzada entre las diferentes especies de rumiantes domésticos (la oveja y la cabra tienen cada una sus propias especies de Eimeria). En las ovejas las especies más patógenas son Eimeria ovinoidalis, Eimeria ahsata, Eimeria bakuensis y Eimeria crandallis; y en las cabras Eimeria ninakohlyakimovae y Eimeria caprina (en la Tabla 1, se muestran todas las especies ovinas y caprinas clasificadas según su importancia patogénica). La coccidiosis puede tener gran importancia económica al estar asociada a cuadros de diarrea en los rumiantes jóvenes, causando tanto procesos clínicos como subclínicos y predisponer a otras enfermedades como el complejo respiratorio ovino o las clostridiosis. No todas las especies de Eimeria de los rumiantes domésticos son patógenas y algunas pueden parasitar al hospedador sin causar una patología intestinal aparente. El control de la coccidiosis incluye la utilización racional de fármacos y la implementación de medidas higiénico-sanitarias adecuadas en la explotación. En el intestino del hospedador se desarrollan los estadios intracelulares del parásito (Figura 1). Los ooquistes no esporulados se eliminan con las heces de los hospedadores infectados, esporulando en el ambiente y convirtiéndose en la fase infectante para un nuevo hospedador (Figura 2). Hospedadores definitivos: Oveja y cabra. Zoonosis: No.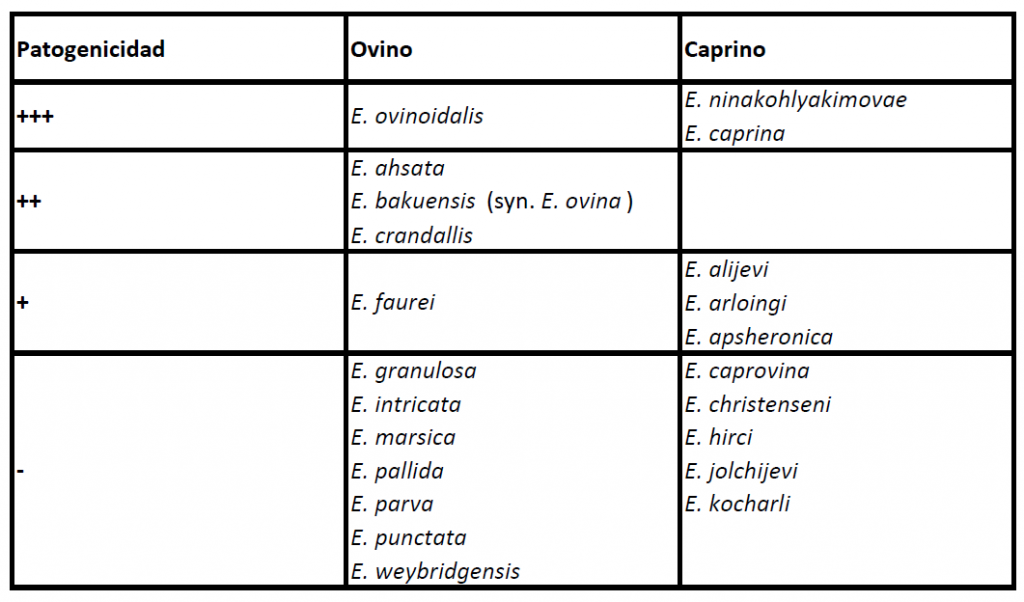
Tabla 1. Especies válidas de Eimeria de ovejas y cabras. Se indica su patogeniedad: +++elevada, ++moderada, +baja, -no existente (modificado de Bangoura B., Bardsley K.D., 2020. Ruminant Coccidiosis. Vet. Clin. North Am. Food Anim. Pract. 36:187-203).
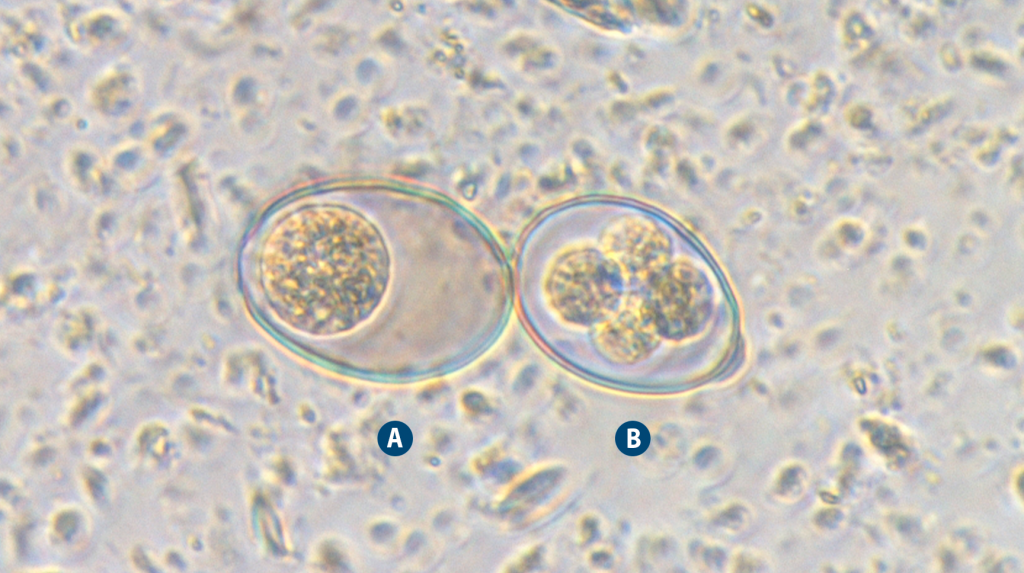
Figura 2. Ooquiste sin esporular (A) y en fase de esporulación (B) de Eimeria spp. MO X400.
¿Cómo es el ciclo biológico de los coccidios? ¿Cómo se infectan los pequeños rumiantes?- El ciclo biológico de Eimeria es directo (monoxeno) entre hospedadores susceptibles (Figura 3). El modo de transmisión es mediante la ruta fecal-oral y la fase infectante es el ooquiste esporulado.
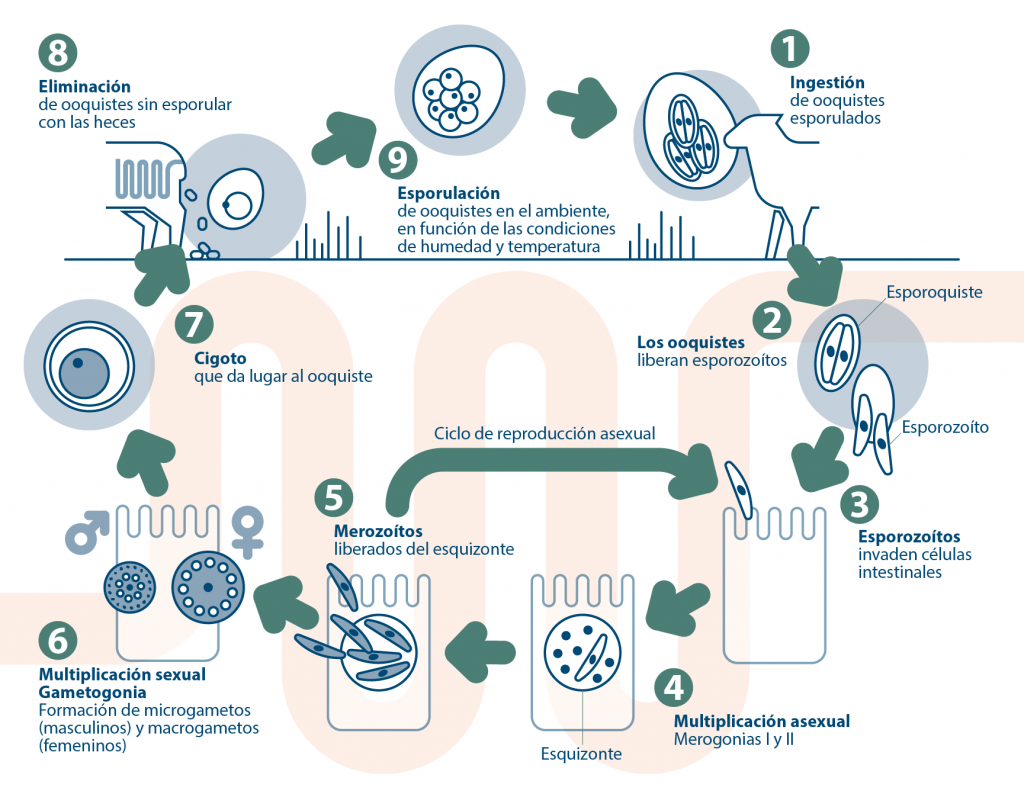
Figura 3. Ciclo biológico de Eimeria. El ciclo biológico de Eimeria incluye dos fases. La primera es endógena y consiste en la multiplicación asexual y sexual del parásito en el intestino. La segunda es exógena e incluye la esporogonia o esporulación de los ooquistes eliminados por el hospedador en el ambiente. El desarrollo endógeno del parásito dura entre 1 y 3 semanas según la especie de Eimeria. La infección tiene lugar por la ingestión de ooquistes esporulados (1). En el intestino y por el estímulo de la temperatura, pH, pepsina, bilis y tripsina, los ooquistes se rompen y liberan los esporozoítos (2). Cada ooquiste contiene un total de 8 esporozoítos infectantes que invadirán los enterocitos desarrollándose en su citoplasma en el interior de una vacuola parasitófora (3). La multiplicación del parásito incluye varios ciclos de reproducción asexual (4), también conocidos como esquizogonias o merogonias. La mayoría de las especies de Eimeria tienen dos ciclos de esquizogonia y algunas hasta tres. En cada esquizogonia se forman cientos de merozoítos en cada vacuola parasitófora que abandonarán la célula hospedadora tras su lisis y pasarán a invadir nuevos enterocitos sanos (5). Finalizadas las fases merogónicas, el parásito comienza la fase de multiplicación sexual o gamogonia que puede desarrollarse también en el intestino grueso (6). Dentro de la célula hospedadora, se forma un microgamonte (precursor del gameto masculino) o un macrogamonte (precursor del gameto femenino). Al madurar el microgamonte libera microgametos, estadios móviles que fecundan al macrogameto. Como consecuencia se forma un cigoto que al madurar constituye el ooquiste (7). Este rompe la célula hospedadora y alcanza el ambiente con las heces del hospedador (8). El periodo de tiempo desde la infección hasta el inicio de la excreción fecal de ooquistes (periodo de prepatencia) varía según la especie de Eimeria. Lo mismo ocurre con la duración de la excreción de ooquistes (periodo de patencia). Los periodos prepatente y patente de las especies de Eimeria de los rumiantes domésticos oscilan entre 6 y 23 días según las especies. Los ooquistes de Eimeria no son infectantes en el momento de la excreción y necesitan un periodo en el ambiente (esporulación) para adquirir la infectividad (9). En condiciones óptimas esta puede tener lugar en tan solo 2 o 3 días. El ooquiste esporulado infectante contiene dos esporoquistes, cada uno de las cuales contiene cuatro esporozoítos, de modo que cada ooquiste esporulado contiene ocho esporozoítos infectantes. Los ooquistes se transmiten directamente entre hospedadores por la ruta fecal-oral. Los hospedadores susceptibles se infectan al ingerir alimentos, beber agua, o lamer superficies contaminadas con material fecal. En ausencia de reinfección, la coccidiosis es una infección autolimitante porque no hay nuevas fases de desarrollo en el interior del intestino una vez que se ha completado el ciclo biológico endógeno y se han excretado los ooquistes.
.
- La coccidiosis debe considerarse siempre como una enfermedad del rebaño y no como un problema en animales individuales.
- En la epidemiología de la coccidiosis intervienen factores dependientes del hospedador y parásito, pero también del ambiente, siendo muy relevante el sistema de manejo.
- La transmisión es más eficaz en las explotaciones con una alta densidad de población y una gran concentración de animales jóvenes. Se produce por vía fecal-oral dentro del rebaño. Los ooquistes también pueden introducirse en un rebaño susceptible por medio de botas y vestimenta, herramientas, vehículos o alimento (pienso-forraje) contaminados.
- Aunque todos los tipos de explotaciones pueden verse afectadas por la coccidiosis, los cebaderos y las explotaciones de producción intensiva corren un mayor riesgo debido a que se facilita la transmisión por existir un mayor número de factores de riesgo.
- Los ooquistes de Eimeria tienen un alto potencial de supervivencia en el ambiente. Pueden permanecer viables e infectantes durante al menos un año y soportar efectos ambientales adversos debido a su gruesa pared.
- La diarrea es el signo clínico característico de la coccidiosis y los corderos de 4 a 5 semanas de edad son los más susceptibles a las lesiones intestinales (Figura 4).
- El efecto patógeno directo causado por la multiplicación del parásito es generalmente mayor durante la segunda o tercera esquizogonia y especialmente durante la gamogonia. Por ello, el mayor efecto patógeno se produce poco antes de que comience la excreción de ooquistes (los periodos de incubación y prepatencia no son iguales).
- Eimeria ovinoidalis causa enteritis grave que se acompañan de yeyunitis diftérica-hemorrágica. La infección en los corderos por E. crandallis causa una infección similar a la de E. ovinoidalis pero más leve, siendo el ciego y el colon los tramos más afectados. E. bakuensis puede dar lugar a la formación de pólipos en el intestino delgado debido a la multiplicación localizada de los últimos estadios parasitarios.
- Las infecciones por ninakohlyakimovae o E. caprina, respectivamente, en cabritos se caracterizan por causar enteritis hemorrágica. Las infecciones por E. arloingi pueden producir pólipos en el intestino delgado y E. apsheronica causa la formación de nódulos blancos en la mucosa que son visibles desde la superficie serosa. E. ninakohlyakimovae y E. caprina son muy patógenas y capaces de causar diarrea entre acuosa y sanguinolenta. Las infecciones por E. arloingi también pueden causar diarrea acuosa.
- La inmunidad que se produce después de la primoinfección es específica de cada especie de Eimeria, es decir, la infección con una especie de Eimeria no protege de forma cruzada frente a infecciones posteriores con otra especie.
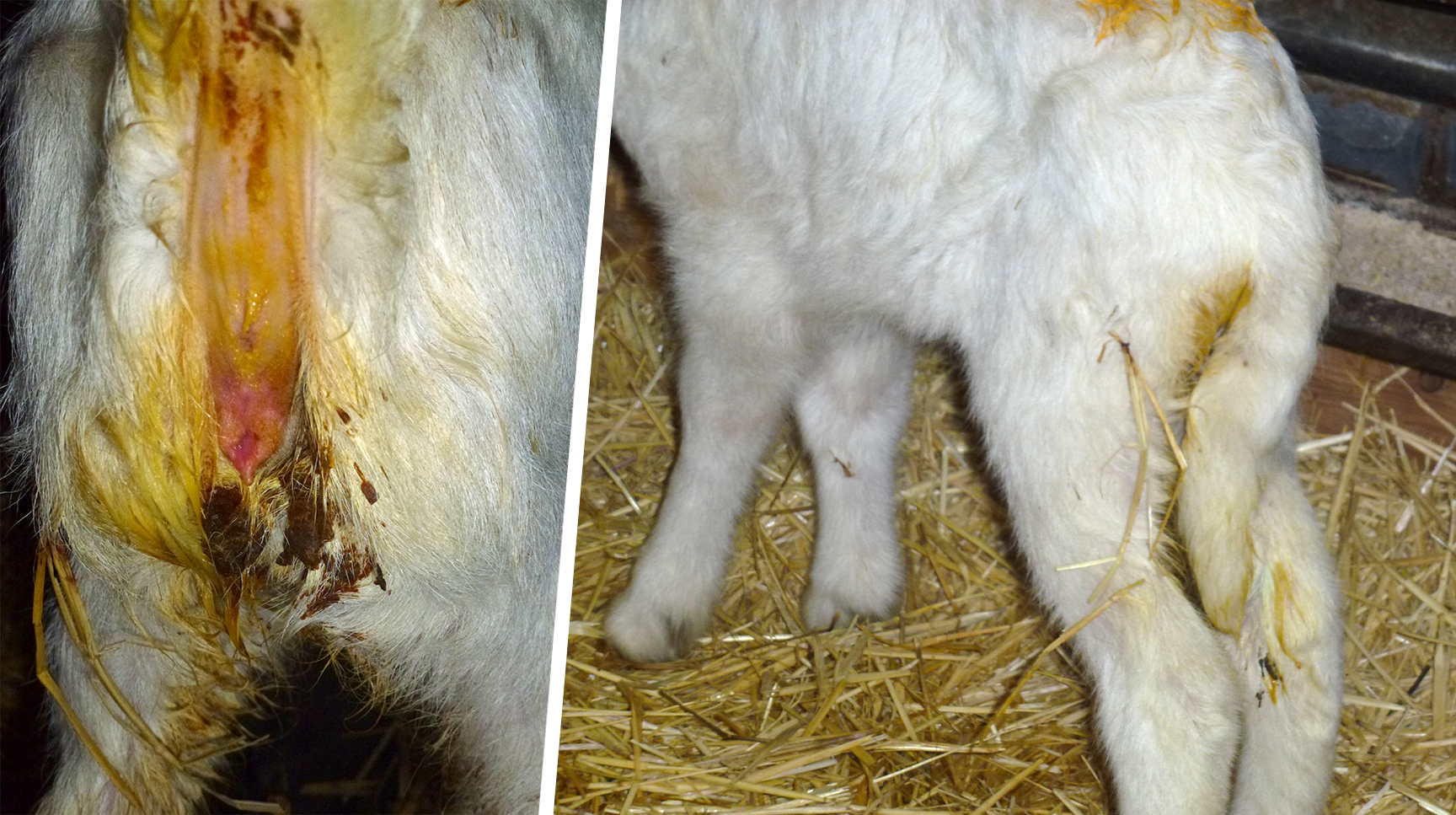
Figura 4. Corderos con diarrea asociada a una coccidiosis.
¿Cómo saber si tengo un problema de coccidiosis en mi granja?- El diagnóstico de la coccidiosis se basa en la observación clínica y la detección de la presencia de ooquistes en muestras fecales de los animales afectados (Figura 2A).
- Es importante destacar que no sólo se debería cuantificar la eliminación de ooquistes, sino también realizar su identificación específica, puesto que muchas especies de Eimeria no son patógenas o son poco patógenas (Tabla 1) y la determinación de las especies implicadas permitiría valorar si los ooquistes detectados están relacionados con la enfermedad clínica. La identificación específica se realiza con ooquistes esporulados estudiando sus características morfométricas.
- Como regla general, la presencia de especies de Eimeria patógenas en un grupo de animales jóvenes se consideraría una amenaza potencial para la salud del rebaño.
- La situación de un rebaño puede monitorizarse mediante muestreos repetidos de los animales a lo largo de varios años y así poder prevenir brotes y garantizar la eficacia de las medidas preventivas o terapéuticas aplicadas. Para el seguimiento se pueden utilizar “pooles” fecales, mientras que los animales enfermos clínicamente deben ser muestreados individualmente. Existen varios métodos cuantitativos, siendo el más utilizado la técnica de McMaster.
- Además del recuento e identificación de ooquistes es importante evaluar otros parámetros sanitario-productivos como el grado de consistencia fecal, ganancia de peso e índice de conversión.
- La exposición a dosis bajas de ooquistes no suele estar relacionada con enfermedad clínica y se considera beneficiosa para el hospedador porque le permiten desarrollar inmunidad protectora, aunque no estéril y protegerlo frente a futuras reinfecciones. Por lo tanto, el objetivo del control de la coccidiosis de los rumiantes consiste en reducir la presión de la infección a niveles no críticos y de estabilidad endémica, más que en la erradicación del patógeno.
- En las explotaciones con problemas de coccidiosis se suelen aplicar fármacos específicos con fines metafilácticos. En general, se dispone de fármacos coccidiostáticos y coccidiocidas. Los coccidiostáticos inhiben el desarrollo de las fases endógenas de los coccidios, mientras que los coccidiocidas matan a los parásitos. En la actualidad, hay fármacos con ambos modos de acción disponibles en el mercado. Los coccidiostáticos están representados por el decoquinato. En cambio, las triazinas, como el toltrazuril y el diclazuril, son coccidiocidas frente a las fases intracelulares. Todos ellos se administran a los corderos por vía oral: 0,5 mg/kg pv al menos durante 28 días el decoquinato y en dosis única a 20 mg/kg pv y 1 mg/kg pv el toltrazuril y el diclazuril respectivamente.
- La opción de control más apropiada es la aplicación metafiláctica de fármacos. La elección de un momento óptimo para el tratamiento permitiría que los animales susceptibles se infectaran y establecieran una respuesta inmunitaria, pero no se desarrollará el parásito de forma excesiva ni las lesiones intestinales consecuentes. Por lo tanto, lo óptimo sería que el tratamiento se aplicara después de la infección, pero antes de que se formen los últimos estadios de desarrollo de los parásitos (14 días después de la infección para las especies de Eimeria más importantes de los rumiantes que es cuando se producen las primeras y segundas merogonias). El tratamiento metafiláctico debe aplicarse a rebaños o grupos de animales porque los animales infectados no se pueden determinar y todos los animales que residen en el mismo lugar contaminado estarán expuestos a las infecciones por Eimeria.
- La prevención se basa en gran medida en la gestión del rebaño, incluidas las medidas higiénicas, ya que no se dispone de ninguna vacuna. Los brotes de coccidiosis son un problema de rebaño y son inducidos por el estrés. Los animales infectados necesitan un sistema inmunitario sólido para evitar una enfermedad grave. Por lo tanto, minimizar o aliviar los factores de estrés como los cambios de dieta, condiciones climáticas adversas, hacinamiento, traslados, reagrupamiento de los animales y exposición a otros agentes patógenos es una parte muy importante de la prevención de la coccidiosis. Además, los ooquistes persisten durante mucho tiempo en el ambiente, especialmente en condiciones de alta humedad. En consecuencia, una buena gestión general que garantice una baja presión de infección mediante la eliminación oportuna del estiércol, el uso de camas abundantes o un pastoreo sin hacinamiento son beneficiosos. Además, las instalaciones con luz natural directa son adecuadas para reducir el número de ooquistes en el entorno. Cuanto menor sea la dosis de infección, menor será el impacto de las infecciones por coccidios en la salud intestinal.
- Hay que destacar que la eliminación completa del patógeno de las instalaciones no es posible ni deseable porque la exposición a dosis bajas de ooquistes asegura el desarrollo de inmunidad en los animales. La desinfección, por ejemplo, con lejía, cresoles o clorocresoles, ayuda a reducir la presión de la infección en el interior de las instalaciones. La separación de los diferentes grupos de edad (es decir, los animales no inmunes de los previamente infectados) ayudará a minimizar la transmisión. La rotación de pastos, siempre que sea posible, es una herramienta útil para evitar la acumulación de altas concentraciones de ooquistes en las zonas dedicadas al pasto de animales jóvenes.